臨床研究センターのご紹介
- Home
- 臨床研究センターのご紹介
| センター長あいさつ | 臨床研究について | 治験について | 患者さん・一般の方へ | 各種委員会について | 治験・製造販売後調査 依頼者の方へ |
センター長あいさつ
済生会横浜市東部病院の臨床研究センターは、当院理念に掲げる「医療を通じて生命(いのち)を守る」をセンターの是として、全ての患者さんに最善の医療を提供するための臨床研究を推進し、医学の発展に寄与することを使命としています。当センターでは、臨床研究部門と治験部門を臨床研究支援の立場で発展的に統合し、臨床研究や治験に関わるひとと業務を支える体制を構築しております。臨床研究をめぐる歴史的背景からは、生命倫理を含めた倫理的課題への反省と改善への普段の努力が重要です。多様な疾患に対する最新の治療法の開発や、医療の質の向上を目指した研究を行うことを通して、地域の皆様や医療従事者との連携を大切にし、社会全体に貢献することを目指しています。
医療の現場は日々進化しており、新たな知見や技術が次々と生まれています。治験・臨床研究をめぐる環境の変化にも、めまぐるしいものがあります。平成30年春には「臨床研究法」、令和3年にはゲノム指針と医学系指針が統合され「人を対象とする生命科学・医学系研究に関する倫理指針」が施行されました。世界では、臨床開発環境の変化に伴い ICH-GCPが日々刷新されています。今後も、新しい治療方法の開発、情報量の急速な増加、IT技術の進化、グローバル化、さらには人工知能の導入等に対応して、規制も進化していくことと思います。
安全かつ有効な臨床研究には、参加される患者さんとご家族をはじめ、医師、薬剤師、看護師、臨床検査技師から、データ管理者、プロジェクトマネージャーを含む多職種の存在と、個人情報保護や倫理の観点からも独立した専門家の存在も不可欠です。当センターでは、これらの最前線で活躍する医療従事者であり、かつ研究者でもある当院職員をサポートし、また患者さんからのご協力を得て実施する臨床試験を通じて、より安全で効果的な治療法の確立に努めています。
治験審査については、倫理的あるいは科学的側面から、治験を受けられる患者さんにとって不利益のないように、患者さんが安心して治験を続けられるよう、医療の専門外の委員や、病院外の委員も含めて定期的に治験を審査しています。未来の医学を築くために、治験はなくてはならない行程ですが、参加される患者さんが医学的にも、倫理的にも透明性をもって適切に守られることが大前提となります。
私たちの取り組みが、少しでも多くの患者様の健康と幸福に寄与できることを願っております。今後とも、済生会横浜市東部病院臨床研究センターへのご支援とご協力を賜りますようお願い申し上げます。
臨床研究センター長 一城 貴政
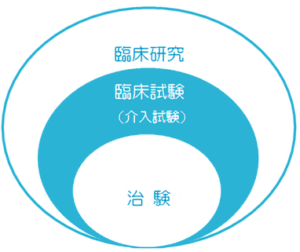 |
臨床研究 | 人を対象として行われる医学研究の全てを指し、病気の予防・診断・治療方法の改善や病気の原因の解明、患者さんの生活の質の向上を目的として行われます。 |
| 臨床試験 | 臨床研究のうち薬剤、治療法、診断法、予防法などの安全性と有効性を人に対して実際に使用して評価することをいいます。 | |
| 治 験 | 臨床試験のうち、新しい薬や医療機器の製造販売の承認を国に得るために行われるものです。 |
臨床研究について
臨床研究とは、病気の原因や進行の仕組みを解明、病気の予防・診断・治療の改善、新しい治療方法の開発、患者さんのQOLの向上を目的に、人を対象として行われる全ての医学研究のことです。
臨床研究センターでは、「人を対象とする生命科学・医学系研究に関する倫理指針」「臨床研究法」の対象となる臨床研究を取扱い、当院の臨床研究の相談・申請等において医療関係者をサポートしている部署です。また、当院の倫理委員会の運営業務も担っています。
臨床研究の情報公開
臨床研究・疫学研究の「同意の手続き」には、患者さんやご家族に研究の内容を直接ご説明し、ご理解いただき、 その上で同意をいただく方法と、研究に関する情報を公開することによって直接のご説明や同意をいただく手続きを行わない方法(オプトアウト)があります。当院では、現在情報を公開することにより実施する研究は以下のとおりです。 情報を利用されることを希望されない研究対象者の方は、各研究の問い合わせ先までご連絡ください。
承認(実施許可)された臨床研究一覧:
これまでに倫理委員会で承認された研究や他院の倫理委員会で審査され当院の実施許可を得た研究をお示ししています。
治験について
治験とは?
人での有効性や安全性について調べる事を「臨床試験」といいます。その中でも、国(厚生労働省)から承認を得るために行われる試験のことを「治験」といいます。
新薬開発~治験~承認・発売までの流れ
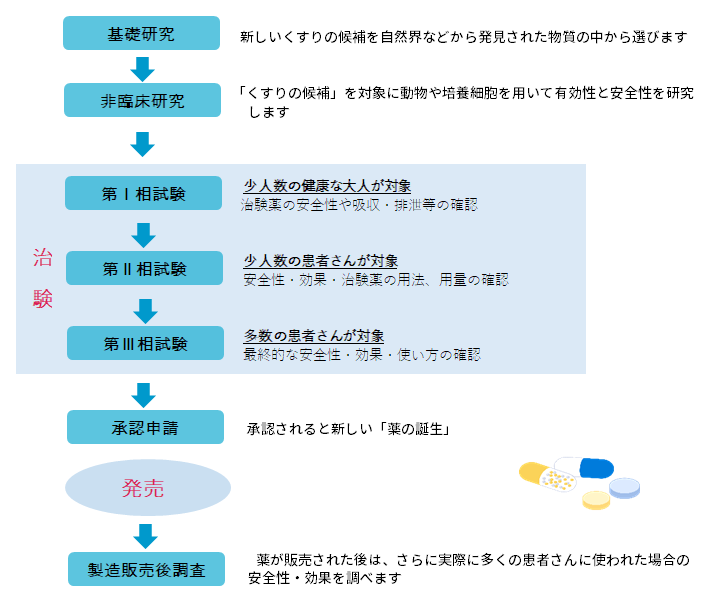
※治験は薬機法、医薬品の臨床試験の実施の基準に関する省令(GCP)、医療機器GCP等の法律で規制されています。
※実施病院はその実施体制が問われ、治験審査委員会での審査が不可欠となります。臨床研究センターは治験審査委員会(IRB)の運営業務を行っています。
治験への参加
治験への参加は、決して強制的なものではありません。
参加するかしないかは、本人の自由意思で決めることが出来ます。
治験担当医師や治験コーディネーターから、参加する治験の内容について説明いたしますので十分ご理解いただいたうえで、参加するかどうかをお決めください。
なお、一度参加を決められた後でも、いつでもやめることが出来ます。
参加を断った場合や、途中でやめたい場合でも、不利益を受けることはありません。
治験のメリット
- まだ治療薬のない疾患に対する治療であれば、他ではできない治療を受けることが出来ます。
- 予測できない副作用にいち早く対応するため、通常の治療より詳しい検査や診察を行い、よりきめ細やかな診察を受けることが出来ます。
- 治験薬を服用している間の治療薬、一部の薬代や検査の費用は依頼者(製薬会社)が負担します。
- 通常の診察に比べ来院回数が増える場合があります。そのため交通費などの負担軽減費が支払われます。
- 研究・治験に参加することが、新しい薬の誕生や将来の医療の進歩に役立ちます。
治験のデメリット
- 説明された以外の未知の副作用が発現する可能性があります。
- 治験によってはプラセボ(成分の入っていない薬剤)を服用していただくことがあります。
- 薬の効果や安全性の確認のため採血や検査、来院回数が増える場合があります。
- 薬の服用状況や体の状態の記録をお願いすることがあります。
- 飲んで良いお薬や運動、食事などに制限がある場合があります。
- 決められた日程で通院、診察・検査を受けて、薬の飲み方などのルールをきちんと守る必要があります。
治験実績(2007年4月~)
| 診療科 | 対象疾患 |
|---|---|
| 小児肝臓消化器科 | 小児潰瘍性大腸炎、小児肝性脳症、アラジール症候群、ウィルソン病、慢性便秘症、肺炎球菌ワクチンなど |
| 循環器内科 | 間欠性跛行、非弁膜症性心房細動、うっ血性心不全、急性心筋梗塞など |
| 精神科 | アルツハイマー型認知症、統合失調症 |
| 小児科 | 小児てんかん、胃関連疾患など |
| 糖尿病・内分泌科 | 2型糖尿病、原発性アルドステロン症、糖尿病性腎症、肥満症、活動性甲状腺眼症、リポタンパク(a)高値、心不全 |
| 脳血管神経内科 | 筋萎縮性側索硬化症、全身型重症筋無力症 |
| 皮膚科 | 爪白癬、尋常性乾癬 |
| 整形外科 | 突発性手根管症候群、膝関節症 |
| 救急科 | 重症セプシス、汎発性血管内凝固症候群 |
| 脳血管内科 | 脳梗塞急性期 |
| 呼吸器内科 | 市中肺炎 |
| 消化器内科 | 非アルコール性脂肪性肝疾患 |
| 産婦人科 | 子宮内膜症 |
| 診療科 | 対象疾患 |
|---|---|
| 循環器内科 | 虚血性心疾患、下肢閉塞性動脈硬化症など |
| 消化器外科 | 直腸がん |
| 血管外科 | 下肢閉塞性動脈硬化症 |
topics
患者さん・一般の方へ
各種委員会について
倫理委員会
倫理委員会は、臨床研究を実施する施設の長(院長)が設置する独立した委員会であり、患者さんが参加する臨床研究が国の法律や倫理指針、科学的な観点に基づいて的確に計画、実行されているかを中立的かつ公正に判断し、臨床研究実施の可否、継続の可否について審議する委員会です。当院には、倫理委員会が設置されており、臨床研究を実施する場合には倫理委員会の承認が必要となります。
会議記録の概要
- 2023年度 第1回
- 2023年度 第2回
- 2023年度 第3回
- 2023年度 第4回
- 2023年度 第5回
- 2023年度 第6回
- 2024年度 第1回
- 2024年度 第2回
- 2024年度 第3回
- 2024年度 第4回
- 2024年度 第5回
- 2024年度 第6回
- 2025年度 第1回
開催予定日 原則奇数月の第1金曜日
治験審査委員会
治験審査委員会は、医師、薬剤師、看護師、臨床検査技師などの専門委員、医療の専門的知識を有しない専門外委員、当院と利害関係を有しない外部委員で構成されています。治験審査委員会は、治験の実施において参加される患者さんの人権・福祉を守り、科学的に問題はないか、治験内容が患者さんに正しく説明されるようになっているか等を審議します。また、受託した治験の進捗状況や安全性なども審議します。
▼会議記録の概要(2025年度)
▼会議記録の概要(2024年度)
- 2024年度 第186回(04月)
- 2024年度 第187回(05月)
- 2024年度 第188回(06月)
- 2024年度 第189回(07月)
- 2024年度 第190回(09月)
- 2024年度 第191回(10月)
- 2024年度 第192回(11月)
- 2024年度 第193回(12月)
- 2024年度 第194回(01月)
- 2024年度 第195回(02月)
- 2024年度 第196回(03月)
▼会議記録の概要(2023年度)
- 2023年度 第175回(04月)
- 2023年度 第176回(05月)
- 2023年度 第177回(06月)
- 2023年度 第178回(07月)
- 2023年度 第179回(09月)
- 2023年度 第180回(10月)
- 2023年度 第181回(11月)
- 2023年度 第182回(12月)
- 2023年度 第183回(01月)
- 2023年度 第184回(02月)
- 2023年度 第185回(03月)
開催日程
治験・製造販売後調査 依頼者の方へ
新規治験開始までの流れ
| 1. | 新規治験依頼のご連絡 臨床研究支援室(治験担当)にメールにてご連絡ください。 宛先:chikentobu@tobu.saiseikai.or.jp |
| ▼ | |
| 2. | 治験責任医師との合意成立 治験責任医師との合意の際にはCRCが同席する場合がありますので日時を事前にお知らせください。 |
| ▼ | |
| 3. |
事前ヒアリング【IRB45~60日前】 ・当院版ICF・治験参加カード等の患者配布資料の確認も事前ヒアリングで行いますので、「患者配布資料作成上の留意事項」をご確認いただき当院版患者配布資料の案もご提出ください。 ・ヒアリング資料は電子媒体で一度お送りいただき、臨床研究支援室での内容確認後に紙媒体でご提出ください。 ・必要書類:ヒアリング資料(臨床研究支援室担当者用) |
| ▼ | |
| 4. | IRB申請 ・必要書類:IRB資料 ・資料部数:26部(治験責任医師事前配布含む)+2部(治験責任医師・治験事務局保管ファイル分) ※治験責任医師・治験事務局保管用のファイルも一緒にお送りください。 ファイル作成時の注意点はこちらをご確認ください。 ・IRB資料一式を電子媒体でもご提出ください。 ・資料提出期限:IRB15日前 |
| ▼ | |
| 5. |
IRB【毎月第2木曜日(8月休会)】 ・IRBで治験概要について治験責任医師に10分程度の説明を求められますので、事前に治験依頼者様と治験責任医師で説明内容について打ち合わせをお願いします。 ・治験依頼者様のIRBへの同席は不要ですが、電話待機をご依頼することがあります。 |
| ▼ | |
| 6. |
契約締結 ・契約書は契約書・臨床試験受託研究費算定要領(写)・登録前脱落症例費用に関する資料・臨床試験研究経費ポイント算出表・治験薬管理経費ポイント算出表・その他費用に関する資料(必要時)をセットにして製本をお願いします。 |
| ▼ | |
| 7. | スタートアップミーティング |
| ▼ | |
| 8. | 治験薬/治験機器搬入 ・搬入日の調整については、院内担当CRCにご相談ください。 |
| ▼ | |
| 9. | 治験開始 |
製造販売後調査の流れ
窓口
医薬品の全例調査※以外の製造販売後調査:臨床研究支援室
医薬品の全例調査※:薬剤部DI室 →手続き等については、薬剤部DI室へご相談ください。
※添付文書の承認条件に「全例の調査を行うこと」が義務付けられている調査
| 1. | 新規調査依頼 あらかじめ調査実施について、調査責任医師の了承を得てください。 |
| ▼ | |
| 2. | 事前ヒアリング 臨床研究支援室(製造販売後調査担当)にメールにてご連絡ください。担当者による調査内容の確認と申請手続きの説明を行います。 宛先:chikentobu@tobu.saiseikai.or.jp |
| ▼ | |
| 3. | IRB申請 申請書類は、ホームページからダウンロードし、必要事項を記入の上、下記資料を提出してください。 資料は電子媒体で一度お送りいただき、臨床研究支援室での内容確認後に紙媒体でご提出ください。 ・必要書類:IRB資料・契約書類・返信用レターパックプラス(通知書送付用) ・IRB資料部数:27部(写し・二穴穴あき)+1部(保管分) ※27部は、資料を委員毎にまとめてお送りください。 ・IRB資料一式を電子媒体でもご提出ください。 ・IRB資料提出期限:IRB15日前 |
| ▼ | |
| 4. | IRB【毎月第2木曜日(8月休会)】 IRBで調査内容の報告を行います。 |
| ▼ | |
| 5. | 契約締結 契約書は契約書・製造販売後調査に係る経費算定要領(写)をセットにして製本をお願いします。 |
| ▼ | |
| 6. | 調査開始 契約締結後に調査を開始してください。 |
| ▼ | |
| 7. | 調査終了 調査終了の際は、下記資料を提出してください。症例の組み入れがない場合も提出が必要です。調査終了報告書は、IRBにて報告しますので、IRB資料として紙媒体でご提出ください。IRB報告後、請求書に基づき、調査受託料の振込をお願いします。 ・必要書類:調査終了報告書(IRB資料)・調査回収状況報告書(書式自由) 返信用レターパックプラス(通知書送付用) ・IRB資料部数:27部(写し・二穴穴あき)+1部(保管分) ・IRB資料を電子媒体でもご提出ください。 ・IRB資料提出期限:IRB15日前 |
治験実施体制
精度管理
当院における精度管理について掲載しております。
精度管理記録は、院内でのみ閲覧可能です。
閲覧をご希望の方は問い合わせ先までお問合せください。
|
・精度管理に関する事項 |
各種手順書・様式ダウンロード
■治験関連
【手順書・内規等】
| 1. | 標準業務手順書 ・企業主導治験に係る標準業務手順書 |
| 2. | 医薬品の臨床試験に係る経費算出要領 ・医薬品の臨床試験に係る経費算出要領 |
| 3. | 直接閲覧を伴うモニタリング・監査の受入れに関する手順書 ・治験における直接閲覧を伴うモニタリング・監査の受入れに関する標準業務手順書 |
| 4. | 管理者/管理補助者指名書 ・治験薬管理者指名書 ・治験薬管理補助者指名書 |
【当院様式】
| 1. | 契約書・覚書 【医薬品】 ・【医薬品】治験受託に関する契約書(二者契約) ・【医薬品】治験契約内容変更に関する覚書(二者契約) ・【医薬品】治験受託に関する契約書(三者契約) ・【医薬品】治験契約内容変更に関する覚書(三者契約) 【医療機器】 ・【医療機器】治験受託に関する契約書(二者契約) ・【医療機器】治験契約内容変更に関する覚書(二者契約) ・【医療機器】治験受託に関する契約書(三者契約) ・【医療機器】治験契約内容変更に関する覚書(三者契約) |
| 2. | 経費算定要領・ポイント算出表等 ・臨床試験受託研究費算定要領 ・臨床研究経費ポイント算出表 ・治験薬管理経費ポイント算出表 ・脱落症例費用に関する資料 |
| 3. | カルテ閲覧申請(SDV) ・臨床研究用電子カルテ閲覧申請書(様式A-27) ・個人情報等機密情報に関する誓約書(外部研究者・院外モニター・監査者用)(様式A-15) |
■製造販売後調査関連
【手順書】
| 1. | 標準業務手順書 ・製造販売後調査に係る標準業務手順書 |
| 【治験・製造販売後調査に関する問い合わせ先】 済生会横浜市東部病院 臨床研究支援室 電話:045-576-3000 メールアドレス:chikentobu@tobu.saiseikai.or.jp |